CUVANT INAINTE
Aceasta pagina este intretinuta de un pacient cu ADPKD/Rinichi polichistici (si ficat polichistic).
Eu sufar de aceasta boala de la 21 de ani, cand am facut prima ecografie. Azi, la 46 de ani (2025), dupa amanarea prin diverse modalitati a intrarii pe dializa, regret ca nu m-am documentat mai devreme, pentru ca puteam sa aman si mai mult degradarea renala. implinesc 1 an de cand fac hemodializa si sunt de 3 ani pe lista de transplant (nu am fost sunat niciodata pana acum).
Sper ca prin aceasta pagina sa pot sa ii ajut pe cat mai multi dintre cei care au ADPKD/Rinichi polichistici, sa invete din greselile mele. 🙂
Abia cand creatinina mi-a trecut de 3 (maximul fiind aprox 1.25) am inceput sa aplic ceea ce veti citi mai jos. Deja era putin prea tarziu.
Mesajul meu pentru cei interesati: exista speranta. Traim intr-o lume in care progresul medicinii este urias, de la zi la alta. Dar, ca sa interceptam ziua in care vom gasi o solutie (sau mai multe) la problema noastra, trebuie sa ne imbunatatim stilul de viata. Este o mica schimbare, dar cu impact profund asupra vietii noastre.
Pentru inceput, voi arata studii medicale de la institute prestigioase de pe planeta care arata cum diverse interventii (alimentatie, slabit, keto, diverse plante pot sa aiba impact pozitiv asupra progresiei rinichilor polichistici ADPKD. Am observat ca ajuta foarte mult cand vorbesti cu doctorii sa le arati sursele studiilor medicale, ca sa nu te creada nebun antivaccinist care isi ia informatiile de pe TikTok si pe urma se mira ca este candidat la premiile Darwin.
IMPORTANT. Daca doriti un raport simplificat, cu informatii relevante din mai multe studii medicale, cu pasi usor de urmat, daca faceti o donatie de 500 de lei Asociatiei StartEvo, o sa va trimit detaliat ce a functionat in cazul meu.
STUDII MEDICALE DESPRE ADPKD – RINICHI POLICHISTICI
Intervenții ketogenice în boala polichistică renală autozomal dominantă: o analiză cuprinzătoare a dovezilor actuale
Literatura recentă sugerează că celulele chistice sunt supuse mai multor dereglări metabolice, în special în calea glucozei, precum și anomaliilor mitocondriale, ceea ce duce la o scădere a fosforilării oxidative și la o oxidare deficitară a acizilor grași. Această constatare a deschis calea către noi direcții de cercetare axate pe identificarea unor potențiale intervenții terapeutice pentru ADPKD.
În special, această analiză evidențiază cele mai recente studii privind utilizarea cetozelor, prin intervenții alimentare ketogenice (restricție calorică zilnică, post intermitent, alimentație cu intervale orare limitate, diete ketogenice și cetoza exogenă), ca strategie potențială pentru pacienții cu ADPKD, precum și posibila implicare a microbiotei în efectele intervențiilor ketogenice.
Sursă: https://www.mdpi.com/2072-6643/16/16/2676
Calea mTOR este reglată de policistina-1, iar inhibarea acesteia inversează cistogeneza renală în boala polichistică renală
Boala polichistică renală autozomal dominantă (ADPKD) este o afecțiune genetică frecventă care duce adesea la insuficiență renală. Mutațiile în policistina-1 (PC1) stau la baza majorității cazurilor de ADPKD, însă funcția PC1 a rămas slab înțeleasă. În prezent, nu există un tratament preventiv pentru această boală.
În acest studiu, se arată că coada citoplasmatică a PC1 interacționează cu tuberina, iar calea mTOR este activată necorespunzător în celulele epiteliale care căptușesc chisturile la pacienții umani cu ADPKD și în modelele de șoareci. Rapamicina, un inhibitor al mTOR, s-a dovedit a fi extrem de eficientă în reducerea cistogenezei renale în două modele independente de PKD la șoareci.
Tratamentul pacienților umani cu ADPKD, receptori de transplant, cu rapamicină a dus la o reducere semnificativă a dimensiunii rinichilor polichistici nativi. Aceste rezultate indică faptul că PC1 are o funcție importantă în reglarea căii mTOR și că această cale oferă o țintă terapeutică promițătoare pentru tratamentul medical al ADPKD.
Sursă: https://www.pnas.org/doi/abs/10.1073/pnas.0509694103
Beneficiile potențiale suplimentare ale intervențiilor dietetice în tratamentul bolii polichistice renale autozomal dominante
Boala polichistică renală autozomal dominantă (ADPKD) este cea mai frecventă cauză ereditară de insuficiență renală. Patogeneza bolii implică mai multe căi și modificări metabolice, inclusiv hiperactivarea căii mTOR și suprimarea semnalizării AMPK, precum și disfuncția mitocondrială.
Această reprogramare metabolică face ca celulele epiteliale care căptușesc chisturile să devină extrem de dependente de glucoză pentru energie și incapabile să oxideze acizii grași.
Dovezile sugerează că dieta bogată în carbohidrați poate agrava progresia ADPKD, oferind astfel un raționament pentru tratarea pacienților cu restricție calorică și, în special, prin intervenții dietetice ketogenice — deja utilizate în alte scopuri, cum ar fi la pacienții supraponderali/obezi sau în tratamentul epilepsiei refractare la copii.
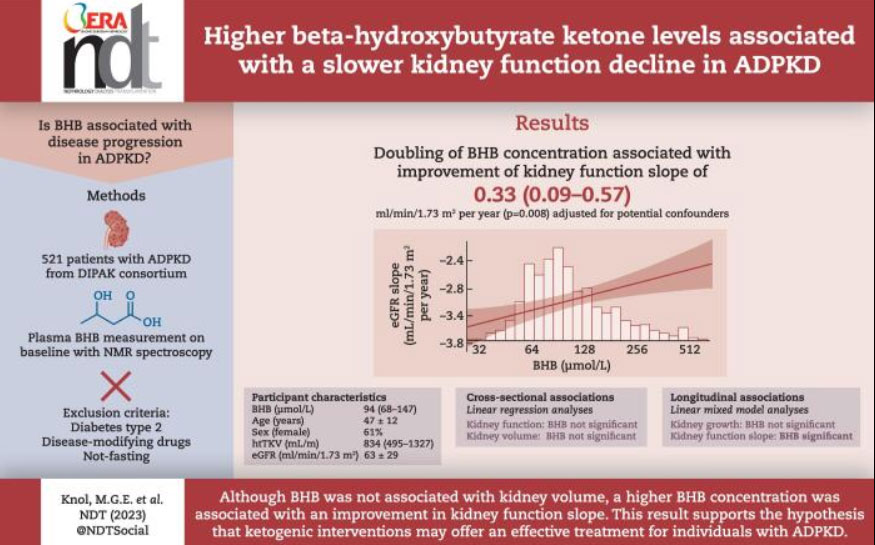
Studiile preclinice au demonstrat că restricția calorică poate preveni și/sau încetini progresia bolii prin inducerea cetozei, în special prin creșterea nivelurilor de beta-hidroxibutirat (BHB), care poate modula căile de semnalizare metabolică alterate în ADPKD.
La acești pacienți, deși datele sunt încă limitate, studiile privind intervențiile ketogenice au arătat efecte benefice promițătoare. Totuși, sunt necesare studii clinice randomizate mai ample și de durată mai lungă pentru a confirma tolerabilitatea și siguranța acestor intervenții pe termen lung, precum și rolul lor aditiv în terapia bolii polichistice renale.
Sursă: https://www.mdpi.com/2072-6643/16/16/2582
O combinație de β-hidroxibutirat și citrat ameliorează progresia bolii într-un model de șobolan cu boală polichistică renală
Cercetările noastre au arătat că intervențiile care induc o stare de cetoza sunt extrem de eficiente în modelele de șobolan, șoarece și pisică cu boală polichistică renală (PKD), prevenind și parțial inversând creșterea chisturilor și progresia bolii. Se pare că corpul cetonic β-hidroxibutiratul (BHB) stă la baza acestui efect.
În plus, am demonstrat că microcristalele formate natural în interiorul tubilor renali declanșează un răspuns renoprotector care facilitează curățarea obstrucțiilor tubulare la animalele sănătoase, dar care, în cazul PKD, duce la formarea de chisturi. Administrarea de citrat previne formarea microcristalelor și încetinește progresia PKD.
Șobolanii tineri Cy/+, un model neortolog de PKD, au primit suplimentare de la vârsta de 3 până la 8 săptămâni cu apă conținând BHB, citrat sau o combinație a acestora, în doze titrate pentru a determina dozele minime eficiente și optime. Șobolanii adulți au primit o combinație redusă de BHB/citrat sau săruri control echimolare de K/NaCl între 8 și 12 săptămâni. În plus, șobolanii adulți au fost plasați în cuști metabolice după administrarea de BHB, citrat și BHB/citrat, pentru a determina impactul asupra excreției de minerale, creatinină și citrat.
Atât BHB, cât și citratul, administrate separat, au ameliorat eficient progresia bolii la șobolanii tineri, reducând markerii bolii chistice, iar în combinație au produs un efect sinergic. Combinația BHB/citrat a dus la o regresie parțială a bolii la șobolanii adulți cu boală chistică avansată, inhibând formarea chisturilor și leziunile renale.
Această combinație oferă beneficii prin mecanisme multiple, crescând excreția de creatinină și citrat și normalizând excreția minerală. BHB și citratul sunt substanțe larg disponibile și recunoscute ca sigure, iar în combinație prezintă un potențial ridicat pentru susținerea sănătății renale în boala polichistică renală.
NOUTATE & RELEVANȚĂ
Combinarea β-hidroxibutiratului (BHB) și a citratului încetinește și previne eficient formarea și extinderea chisturilor la șobolanii tineri Cy/+, folosind cantități mai mici de BHB și citrat decât atunci când sunt administrate separat, demonstrând sinergie.
La șobolanii adulți, combinația determină o inversare parțială a bolii existente, reducând numărul și aria chisturilor, menținând sănătatea glomerulară și scăzând markerii de afectare renală. Rezultatele noastre sugerează o strategie sigură și fezabilă pentru susținerea sănătății renale în boala polichistică renală (PKD) prin utilizarea unei combinații de BHB și citrat.
Sursă: https://journals.physiology.org/doi/full/10.1152/ajprenal.00205.2023
Cărbunele activat administrat oral întârzie eficient apariția hiperfosfatemiei la pacienții cu boală cronică de rinichi
Administrarea orală de cărbune activat (OAC) s-a dovedit eficientă în întârzierea instalării hiperfosfatemiei la pacienții cu boală cronică de rinichi (CKD). De asemenea, OAC pare să încetinească dezvoltarea calcificărilor vasculare la pacienții aflați în stadiile 3–4 ale CKD.
Sursă: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6422957/
Administrarea de cărbune activat reduce afectarea mucoasei colonice indusă de uremie și endotoxemia asociată, inflamația și progresia bolii cronice de rinichi, în special când suplimentarea este începută precoce
S-a demonstrat că administrarea de cărbune activat atenuează distrugerea mucoasei colonice indusă de uremie, precum și endotoxemia, inflamația și progresia bolii cronice de rinichi (CKD), mai ales atunci când tratamentul este inițiat în stadiile timpurii.
Rezultate:
Atât administrarea precoce, cât și cea tardivă de cărbune activat au dus la o scădere semnificativă a nivelurilor serice de uree, creatinină și proteină C reactivă (CRP). De asemenea, s-a observat o îmbunătățire relativă a creșterii în greutate corporală, o restaurare parțială a integrității mucoasei colonice și o reducere a indicelui de fibroză renală la animalele tratate cu cărbune activat.
Indoxil sulfatul a fost redus semnificativ doar în cazul tratamentului precoce. Totuși, cărbunele activat nu a putut contracara modificările tensiunii arteriale diastolice asociate CKD.
Sursă: https://academic.oup.com/qjmed/article/111/suppl_1/hcy200.190/5244367
Data: 13 decembrie 2018
Compuși derivați din plante pentru tratarea bolii polichistice renale autozomal dominante
Boala polichistică renală autozomal dominantă (ADPKD), cea mai frecventă boală renală ereditară monogenică, reprezintă a patra cauză principală de boală renală în stadiu terminal la nivel mondial.
În ultimii ani, s-au făcut progrese semnificative în încetinirea progresiei ADPKD prin utilizarea diferitelor medicamente chimice, precum tolvaptan, rapamicina și somatostatina.
În paralel, numeroși compuși derivați din plante au fost investigați pentru efectele lor benefice în încetinirea progresiei ADPKD. Printre aceștia se numără:
-
saikosaponina-d,
-
triterpenele din Ganoderma,
-
curcumina,
-
ginkgolida B,
-
steviolul,
-
resveratrolul,
-
Sparganum stoloniferum Buch.-Ham,
-
Cordyceps sinensis,
-
triptolida,
-
quercitrina,
-
naringina,
-
cardamonina,
-
acidul gambogic și
-
extractul de frunză de măslin.
Acești compuși au demonstrat capacitatea de a încetini dezvoltarea chisturilor renale prin inhibarea proliferării celulare sau promovarea apoptozei în celulele epiteliale care căptușesc chisturile.
De asemenea, metformina, un compus sintetic derivat din planta liliacul francez (Galega officinalis), s-a dovedit eficientă în încetinirea progresiei ADPKD.
Această analiză se concentrează asupra rolurilor și mecanismelor compușilor de origine vegetală în tratamentul ADPKD, sugerând că aceștia ar putea constitui noi terapii promițătoare în viitor.
Sursă: https://www.frontiersin.org/articles/10.3389/fneph.2023.1071441/full
Data: 3 februarie 2023
Intervențiile dietetice ketogenice în boala polichistică renală autozomal dominantă — un studiu retrospectiv de tip serie de cazuri: prime perspective asupra fezabilității, siguranței și efectelor
Sursă: Clinical Kidney Journal
https://academic.oup.com/ckj/article/15/6/1079/6369511
Data: 13 septembrie 2021
Rezumat
Context
Laboratorul nostru a publicat primele dovezi conform cărora cetoza nutrițională, indusă prin dietă ketogenică (KD) sau dietă cu restricție temporală (TRD), ameliorează progresia bolii în modelele animale de boală polichistică renală (PKD).
Am presupus că, datorită utilizării frecvente a acestor diete pentru diverse beneficii asupra sănătății, unii pacienți cu boală polichistică renală autozomal dominantă (ADPKD) ar fi putut avea deja experiență cu intervenții dietetice ketogenice (KDI).
Acest studiu retrospectiv de tip serie de cazuri a fost conceput pentru a colecta primele observații reale de la pacienți cu ADPKD privind siguranța, fezabilitatea și potențialele beneficii ale KDI, ca parte a unui proiect translațional.
Metode
Pacienții cu ADPKD care au utilizat anterior intervenții dietetice ketogenice au fost recrutați pentru a furniza date observaționale și medicale referitoare la efectele benefice sau adverse, precum și la fezabilitatea și siguranța acestor intervenții, prin interviuri bazate pe chestionare.
Rezultate
Un total de 131 de pacienți cu ADPKD au participat la studiu:
-
74 au urmat o dietă ketogenică (KD)
-
52 au urmat o dietă cu restricție temporală (TRD)
Durata medie a dietei a fost de 6 luni.
Principalele rezultate raportate:
-
86% dintre participanți au afirmat că intervențiile ketogenice le-au îmbunătățit starea generală de sănătate.
-
67% au observat îmbunătățiri ale simptomelor asociate ADPKD.
-
90% au înregistrat scădere semnificativă în greutate.
-
64% dintre participanții hipertensivi au raportat îmbunătățiri ale tensiunii arteriale.
-
66% au menționat efecte adverse minore, frecvent întâlnite în cazul dietelor ketogenice.
-
22 de participanți au semnalat probleme de siguranță, precum hiperlipidemie.
-
45 de participanți au raportat îmbunătățiri ușoare ale ratei de filtrare glomerulară estimate (eGFR).
-
92% au considerat că dieta este fezabilă, deși 53% au declarat că au făcut pauze pe parcursul dietei.
Concluzii
Datele preliminare indică faptul că intervențiile dietetice ketogenice (KDI) pot fi sigure, fezabile și potențial benefice pentru pacienții cu ADPKD.
Rezultatele subliniază necesitatea unor studii clinice prospective, controlate, pentru a confirma aceste constatări și pentru a clarifica impactul specific al KDI asupra funcției renale și progresiei chisturilor.
Restricția alimentară ameliorează dezvoltarea bolii polichistice renale
Sursă: Journal of the American Society of Nephrology
https://journals.lww.com/jasn/pages/articleviewer.aspx?year=2016&issue=05000&article=00022&type=Fulltext
Data: mai 2016
Rezumat
În acest studiu, s-a demonstrat că restricția alimentară (FR – food restriction) încetinește în mod eficient evoluția bolii în modelele de șoarece cu boală polichistică renală autozomal dominantă (ADPKD).
O reducere ușoară până la moderată a aportului alimentar (între 10% și 40%) a condus la scăderea ariei chisturilor, a fibrozei renale, a inflamației și a leziunilor tisulare, într-o manieră dependentă de doză.
Studiile moleculare și biochimice efectuate pe acești șoareci arată că restricția alimentară ameliorează ADPKD printr-un mecanism care implică:
-
suprimarea căii mTOR (mammalian target of rapamycin) și
-
activarea căii LKB1/AMPK (liver kinase B1 / AMP-activated protein kinase).
Datele obținute sugerează că intervențiile dietetice, precum restricția alimentară, sau tratamentele care imită efectele acestora, pot reprezenta opțiuni preventive și terapeutice noi pentru pacienții cu ADPKD.
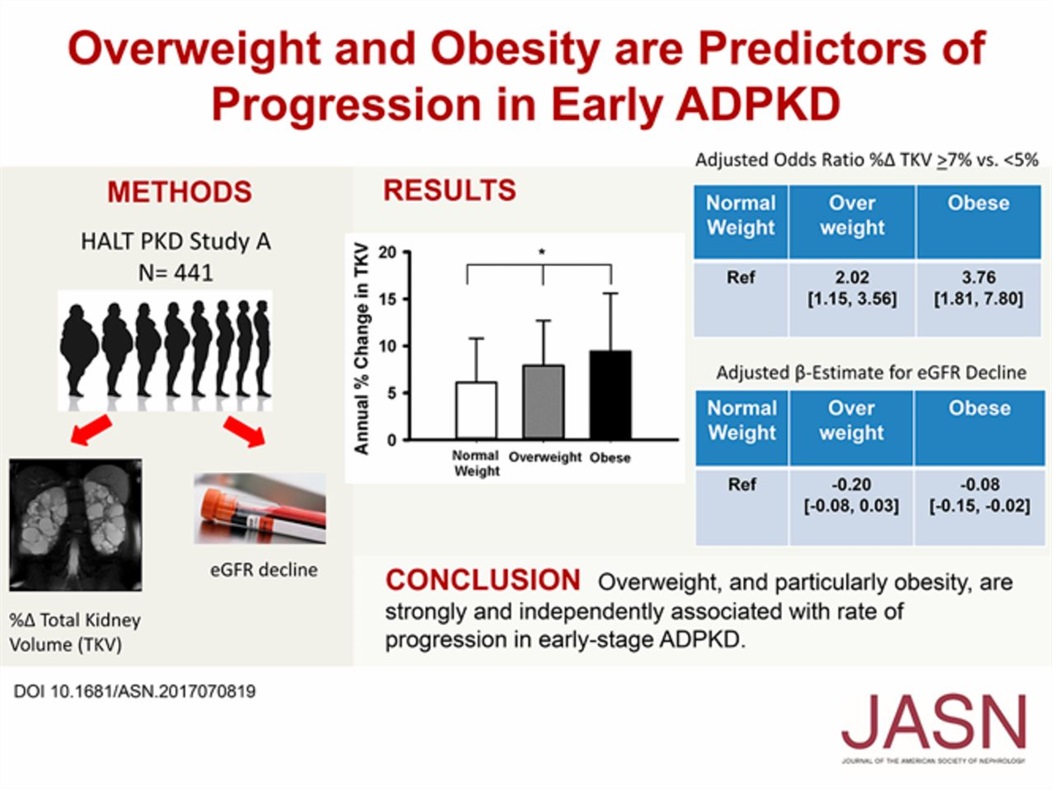
Supraponderabilitatea și obezitatea sunt factori predictivi ai progresiei în stadiile incipiente ale bolii polichistice renale autozomal dominante
Sursă: Journal of the American Society of Nephrology
https://journals.lww.com/jasn/fulltext/2017/04000/overweight_and_obesity_are_predictors_of.15.aspx
Date: 2018.02
Rezumat
Acest studiu a investigat relația dintre indicele de masă corporală (IMC) și progresia bolii polichistice renale autozomal dominante (ADPKD) în stadiile incipiente.
Rezultatele arată că supraponderabilitatea și obezitatea sunt predictori independenți ai progresiei accelerate a bolii, fiind asociate cu:
-
creșterea volumului total al rinichilor,
-
scăderea ratei de filtrare glomerulară (eGFR) și
-
agravarea inflamației și a stresului oxidativ la nivel renal.
Analizele au demonstrat o corelație directă între IMC ridicat și extinderea chisturilor renale, sugerând că greutatea corporală crescută contribuie la accelerarea deteriorării funcției renale la pacienții cu ADPKD.
Concluziile studiului subliniază importanța menținerii unei greutăți corporale normale ca parte a strategiilor de încetinire a progresiei bolii și de protecție a funcției renale în stadiile timpurii ale ADPKD.
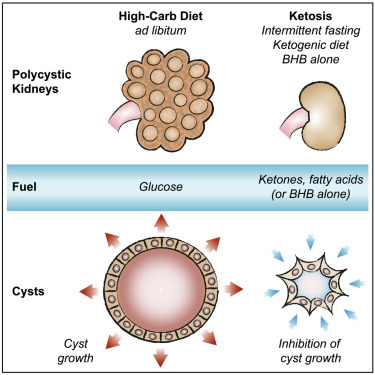
Cetoza ameliorează creșterea chisturilor renale în boala polichistică renală
Sursă: Clinical and Translational Report
https://doi.org/10.1016/j.cmet.2019.09.012
Data: 3 decembrie 2019
Rezumat
-
Cetoza previne sau inversează boala polichistică renală (PKD) în modelele animale.
-
Modificările alimentare care induc cetoza previn dezvoltarea PKD.
-
Suplimentarea orală cu β-hidroxibutirat (BHB) inhibă progresia PKD chiar și în absența dietei ketogenice.
-
Celulele chistice sunt metabolic rigide, iar această caracteristică poate fi exploatată terapeutic.
O reducere moderată a aportului alimentar s-a dovedit recent a încetini progresia bolii polichistice renale (PKD) la șoareci, însă nu era clar dacă efectul se datora scăderii caloriilor sau altor factori ai dietei.
Acest studiu demonstrează că beneficiul provine din inducerea cetozei.
Alimentația cu restricție temporală, fără reducerea caloriilor totale, inhibă puternic semnalizarea mTOR, proliferarea celulară și fibroza în rinichii afectați la șobolanii cu PKD.
O dietă ketogenică a avut un efect similar, ducând la regresia volumului chistic renal.
Postul acut la șobolani, șoareci și pisici cu PKD a produs o reducere rapidă a volumului chistic, iar administrarea orală de β-hidroxibutirat (BHB) la șobolani a inhibat semnificativ progresia bolii.
Aceste rezultate sugerează că celulele chistice în PKD sunt metabolic inflexibile, iar această vulnerabilitate poate fi exploatată prin intervenții dietetice sau suplimentare cu BHB, reprezentând o nouă direcție terapeutică promițătoare pentru tratarea bolii polichistice renale.
Si acum, putina teorie si statusul actual
Raport Expert: Boala Polichistică Renală Autosomal Dominantă (ADPKD) – De la Mecanisme Genetice la Orizontul Terapeutic al Secolului XXI
I. Introducere, Epidemiologie și Genetica Fundamentală a Rinichilor Polichistici (ADPKD)
I.A. Definiție și Impact Epidemiologic
Boala polichistică renală autosomal dominantă (ADPKD) reprezintă cea mai frecventă afecțiune genetică sistemică la om și constituie, de departe, cea mai comună cauză genetică de insuficiență renală (IR) la nivel mondial. Această patologie este caracterizată prin dezvoltarea progresivă și bilaterală a multiple chisturi, care duc la o creștere masivă a Volumului Renal Total (TKV) și, în cele din urmă, la distrugerea parenchimului funcțional.
Din punct de vedere epidemiologic, prevalența raportată a ADPKD variază între 1:400 și 1:1000 de locuitori. Relevanța sa clinică este evidențiată de faptul că 4% până la 5% dintre pacienții care necesită Terapie de Substituție Renală (TRS), fie dializă, fie transplant, sunt diagnosticați cu ADPKD. Deși evoluția clinică este definită de pierderea progresivă a funcției renale ca urmare a acumulării de chisturi , este crucial de notat că morbiditatea și mortalitatea sunt adesea dominate de complicațiile extra-renale. Complicațiile cardiovasculare, în special hipertensiunea arterială (HTA) și riscul asociat de anevrisme vasculare cerebrale, sunt recunoscute ca fiind cauze principale de deces în această populație.
I.B. Baza Moleculară: Mutațiile Genei PKD1 și PKD2
Etiologia ADPKD este direct legată de mutații în unul dintre cele două gene majore: PKD1 (localizată pe cromozomul 16) sau PKD2 (localizată pe cromozomul 4). Termenul “autosomal dominant” implică faptul că moștenirea unei singure copii mutate a genei de la un părinte afectat este suficientă pentru a determina manifestarea bolii.
Aceste gene codifică pentru proteinele Polycystin-1 (PC-1) și Polycystin-2 (PC-2). În mod normal, PC-1 și PC-2 formează un complex de receptori localizat în cilul primar al celulelor epiteliale tubulare renale. Cilul primar funcționează ca un senzor mecanic și chimic de flux, iar complexul Polycystin joacă un rol esențial în reglarea creșterii celulare, a diferențierii și a secreției de fluid tubular.
Mecanismul patogenic central al ADPKD este inițierea și expansiunea chisturilor, un proces complex care rezultă dintr-o combinație de proliferare celulară anormală a epiteliului tubular și secreție excesivă de fluid chistic. Cercetările sugerează că acest fenomen se declanșează atunci când nivelurile funcționale de PC-1 sau PC-2 scad sub un prag critic. Pacienții cu ADPKD moștenesc o copie mutantă și o copie normală a genei relevante, iar dezvoltarea chisturilor este explicată de modelul “doi lovituri” (two-hit model), prin care o a doua mutație somatică inactivantă (pierderea heterozigoției) apare în celula tubulară restantă, ducând la pierderea funcției PC și la creșterea necontrolată a celulelor.
I.C. Corelația Genotip-Fenotip și Implicațiile Prognostice
Există o diferență fenotipică semnificativă în funcție de gena afectată. Mutațiile PKD1 sunt asociate cu o formă de boală mult mai severă, caracterizată prin rinichi cu volum mai mare și o progresie mai rapidă către insuficiența renală. În cazul mutațiilor PKD1, vârsta medie de intrare în dializă este de aproximativ 55 de ani. Pe de altă parte, pacienții cu mutații PKD2 prezintă o boală mai blândă, cu un debut mai târziu al simptomelor și o vârstă medie de necesitate a TRS mult mai mare, în jurul vârstei de 75 de ani. Această diferență de 20 de ani în progresia bolii subliniază rolul esențial al genotipului în stabilirea prognosticului.
Deși varianta PKD1 este asociată cu severitate, studiile mai recente au identificat un subset de pacienți purtători de mutații PKD1 cu o boală mai ușoară, în care mutația nu pare să ducă la o inactivare completă a Polycystinei-1, permițând o funcție reziduală. Este, de asemenea, important de subliniat faptul că, în cadrul aceleiași familii, toți pacienții afectați care poartă aceeași mutație vor avea același tip de ADPKD, deși expresia clinică individuală poate varia.
Cunoașterea detaliată a geneticii bolii nu este doar un exercițiu diagnostic, ci un instrument esențial de triage terapeutic timpuriu. Deoarece farmacoterapia specifică (de exemplu, Tolvaptan) este indicată strict pentru pacienții cu progresie rapidă a bolii, iar genotipul PKD1 este un predictor major al acestei progresii (cu 20 de ani mai rapidă decât PKD2), cunoașterea genotipului devine o condiție sine qua non pentru o stratificare precisă a riscului. Astfel, deși testarea genetică poate fi costisitoare , integrarea ei timpurie în procesul de diagnostic este justificată de potențialul de a iniția la timp terapia de încetinire a bolii la grupurile de risc înalt.
II. Manifestări Clinice, Diagnostic și Evaluarea Riscului
II.A. Tabloul Clinic și Complicațiile Sistemice
ADPKD este o boală sistemică, iar manifestările sale depășesc disfuncția renală. Complicațiile tipice includ durerea, HTA și, în stadiile avansate, insuficiența renală.
Hipertensiunea Arterială (HTA): Aproape toți pacienții cu ADPKD care progresează spre insuficiență renală dezvoltă HTA. HTA debutează adesea înainte de declinul semnificativ al ratei de filtrare glomerulară și este un factor major de accelerare a deteriorării renale. Mai mult, HTA crește drastic riscul de accidente vasculare cerebrale (AVC) și boli cardiace.
Durerea: Durerea este o plângere extrem de comună, cauzată de obicei de creșterea și distensia capsulei renale prin chisturi mari sau chisturi hepatice. Alte cauze frecvente de durere acută includ infecțiile chistice, sângerarea sau ruptura chisturilor, și prezența calculilor renali (litiază).
Anevrismul Vascular Cerebral: Prezența și complicațiile asociate cu anevrismele vasculare cerebrale reprezintă un factor critic de prognostic negativ, fiind monitorizate alături de evoluția funcției renale și controlul HTA.
II.B. Strategii de Diagnostic Multimodal
Diagnosticul ADPKD se bazează pe o combinație de istoric familial, examinare fizică și teste specializate.
Evaluarea Inițială: Istoricul medical familial este crucial, dată fiind transmiterea autosomal dominantă a bolii. Examenul fizic poate releva semne de mărire renală sau alte simptome.
Imagistica: Testele imagistice (ecografie, tomografie computerizată – CT, sau imagistică prin rezonanță magnetică – RMN) sunt standardul de aur pentru vizualizarea rinichilor și detectarea prezenței chisturilor. Imagistica este de o importanță capitală nu doar pentru diagnostic, ci și pentru monitorizarea Volumului Renal Total (TKV), care este un indicator esențial al progresiei bolii și este utilizat pentru a determina eligibilitatea pacienților pentru tratamente farmacologice specifice.
Testarea Genetică: Identificarea mutațiilor specifice în genele PKD1 sau PKD2 confirmă diagnosticul. Un diagnostic mai precoce oferă medicilor posibilitatea de a iniția managementul agresiv al complicațiilor și de a încetini progresia bolii.
II.C. Prioritatea Managementului Cardiovascular
Deși ADPKD este definită de creșterea chisturilor, o înțelegere nuanțată a fiziopatologiei plasează controlul cardiovascular în prim-planul managementului. HTA este indusă precoce, adesea înainte de scăderea semnificativă a VFR, ca rezultat al ischemiei cauzate de compresia țesutului renal de către chisturile în expansiune. Această ischemie duce la supra-activarea Sistemului Renină-Angiotensină-Aldosteron (RAAS).
Deteriorarea renală progresivă și complicațiile sistemice sunt, în esență, efecte secundare ale HTA necontrolate și ale riscului de anevrisme. Prin urmare, standardul de îngrijire impune ca ADPKD să fie tratată nu doar ca o boală chistică renală, ci la fel de mult ca o boală cardiovasculară primară. Acest lucru necesită un accent maxim pe atingerea țintelor tensionale agresive cât mai devreme posibil în cursul bolii.
II.D. Considerații Etice în Screeningul Pediatric
Datorită naturii dominate de riscuri și intervenții limitate la vârste mici, screeningul copiilor sub 18 ani nu este în general recomandat decât dacă există o terapie specifică aprobată pentru această grupă de vârstă.
Părinții și medicii se confruntă cu dileme etice semnificative: beneficiile unui diagnostic precoce (care permite adoptarea unui stil de viață sănătos și monitorizarea funcției renale) trebuie cântărite împotriva riscurilor potențiale, inclusiv anxietatea psihologică a copilului și dificultățile în obținerea asigurărilor medicale sau de viață. În multe cazuri, familiile aleg să amâne testarea genetică costisitoare, preferând să trăiască un stil de viață sănătos și să monitorizeze funcția renală, rezervând decizia de testare pentru momentul în care apar simptomele sau noi oportunități terapeutice.
III. Managementul Terapeutic Actual al Progresiei Bolii
III.A. Terapia Medicamentoasă Specifică: Tolvaptan
În prezent, Tolvaptan reprezintă cea mai importantă inovație farmacologică aprobată pentru managementul ADPKD.
Indicație și Mecanism: Tolvaptan este un antagonist al Receptorului V2 de Vasopresină, indicat pentru tratamentul adulților (cu vârsta de 18 ani și peste) cu ADPKD cu progresie rapidă. Vasopresina, un hormon eliberat în condiții de hidratare insuficientă, stimulează producția de adenozin monofosfat ciclic (cAMP) în celulele tubulare. cAMP este un factor pro-creștere critic, care promovează proliferarea celulară și secreția de fluid, accelerând expansiunea chisturilor. Prin blocarea receptorului V2, Tolvaptan reduce nivelurile de cAMP, încetinind astfel rata de creștere a chisturilor și, consecutiv, declinul Volumului Renal Funcțional (VFR).
Monitorizare și Administrare: Ghidurile clinice practice subliniază necesitatea unei monitorizări stricte a pacienților tratați cu Tolvaptan, în special a funcției hepatice, din cauza riscului documentat de toxicitate hepatică asociată medicamentului. Momentul inițierii tratamentului este critic și se bazează pe evaluarea riscului de progresie rapidă, utilizând criterii care includ genotipul, Volumul Renal Total și vârsta pacientului.
III.B. Managementul Hipertensiunii Arteriale (HTA)
Controlul HTA este o piatră de temelie în managementul ADPKD și un predictor esențial al rezultatelor pe termen lung.
Patogeneză: HTA este inițiată de activarea RAAS, care rezultă din ischemie locală cauzată de mărirea chisturilor care comprimă vasculatura renală.
Tratamentul Farmacologic: Inhibitorii Enzimei de Conversie a Angiotensinei (IECA) și Blocanții Receptorilor de Angiotensină (SARTANs) sunt agenții antihipertensivi de primă linie, deoarece adresează direct patogeneza HTA prin blocarea RAAS. Obiectivul terapeutic este controlul agresiv al tensiunii arteriale pentru a încetini progresia nefropatiei chistice și, cel mai important, pentru a reduce riscul major de complicații cardiovasculare asociate.
III.C. Strategia Blocadei Vasoactive Duale
Managementul optim al ADPKD utilizează o strategie care abordează simultan cele două căi patogenice majore: axa Vasopresină-cAMP, responsabilă de proliferarea chisturilor, și axa Renină-Angiotensină, responsabilă de HTA și fibroza renală.
Tolvaptan acționează asupra axei Vasopresină-cAMP , în timp ce IECA/SARTANs blochează RAAS. Interesant, chiar și intervențiile nutriționale (hidratarea agresivă) acționează pe axa Vasopresină-cAMP. Prin combinarea blocadei farmacologice a RAAS cu suprimarea cAMP (fie prin Tolvaptan, fie prin hidratare intensivă), medicii maximizează șansele de a întârzia declinul VFR. Această abordare combinată reprezintă o “blocadă vasoactivă duală,” țintind ambele mecanisme care stau la baza progresiei bolii.
III.D. Managementul Complicațiilor (Durere, Infecții)
Managementul durerii cronice implică adesea utilizarea de analgezice. În cazurile de durere persistentă legată de volumul renal masiv, pot fi necesare intervenții chirurgicale sau radiologice, cum ar fi scleroterapia chistică sau, în cazuri extreme, nefrectomia (îndepărtarea rinichilor extrem de măriți, adesea înainte de transplant).
Infecțiile chisturilor renale sau hepatice sunt considerate urgențe medicale și necesită un tratament antibiotic de lungă durată, cu selecția atentă a agenților care asigură o penetrare tisulară eficientă în lichidul chistic.
IV. Soluții Nutriționale și Modificări Ale Stilului de Viață
Intervențiile nutriționale și modificările stilului de viață joacă un rol auxiliar, dar esențial, în managementul ADPKD, acționând adesea prin mecanisme moleculare similare cu cele ale terapiei medicamentoase.
IV.A. Hidratarea Agresivă: Suprimarea Vasopresinei
O strategie comportamentală critică este menținerea unei hidratări generoase. Obiectivul este un output urinar zilnic de 2-3 quarte (aproximativ 1.9-2.8 L) de urină, monitorizat simplu prin menținerea unei culori pale a urinei.
Mecanismul Anti-chistic: Acest nivel de hidratare excesivă acționează prin diluarea urinei și menținerea unui volum sanguin adecvat, ceea ce suprimă eliberarea de vasopresină din hipofiză. Prin reducerea vasopresinei, se scade stimularea producției de cAMP în celulele tubulare, încetinind proliferarea chistică, similar cu efectul Tolvaptan.
Restricția de Cofeină: Deoarece cofeina încetinește degradarea cAMP, limitarea aportului de cofeină este recomandată logic pentru a menține niveluri scăzute ale acestui mesager secundar și a minimiza creșterea chisturilor.
Atenționări Clinice: Este vital ca pacienții să discute aportul de apă cu nefrologul lor, deoarece, pe măsură ce funcția renală se deteriorează, capacitatea corpului de a gestiona volume mari de fluid scade, iar hidratarea excesivă poate deveni periculoasă.
IV.B. Regimul Alimentar: Proteine, Sare și Minerale
- Sare (Sodiu): Deși HTA în ADPKD nu este cauzată primar de aportul de sare, excesul trebuie evitat. Scăderea aportului alimentar de sare este utilă în controlul HTA, mai ales la pacienții care iau medicamente ce blochează RAAS (IECA/SARTANs) și în stadiile avansate de IR. Recomandările includ utilizarea condimentelor fără sare, evitarea alimentelor procesate și monitorizarea etichetelor nutriționale (verde <0.3g sare/100g, roșu >1.5g sare/100g).
- Proteine: Nu există dovezi convingătoare care să susțină restricția proteică la pacienții cu ADPKD care nu sunt în insuficiență renală semnificativă. Studiul MDRD (Modification in Diet in Renal Disease) nu a demonstrat beneficii clare în încetinirea progresiei bolii la pacienții cu PKD. Totuși, se consideră prudentă evitarea dietelor hiperproteice. Pentru pacienții cu IR moderată sau avansată, o restricție modestă, țintind 0.8 g de proteină pe Kg corp pe zi, poate fi necesară pentru a reduce acumularea de produși de deșeu uremici.
- Managementul Mineralelor: Pe măsură ce funcția renală (VFR) scade, echilibrul mineral devine o preocupare majoră. Pacienții pot necesita ajustarea aportului de fosfor la aproximativ 800 mg/zi (față de 800-1200 mg/zi la indivizii sănătoși). Poate fi necesară administrarea de lianți de fosfor. Calciul și magneziul sunt de asemenea minerale critice, care trebuie monitorizate și ajustate, fiind esențiale pentru sănătatea osoasă.
Consultarea cu un nefrolog și un dietetician specializat în boli renale este obligatorie pentru a dezvolta un plan nutrițional individualizat care se va adapta pe măsură ce boala progresează de la stadiul pre-dializă la post-transplant. Dieta DASH (Dietary Approach to Stopping Hypertension) este adesea considerată un model nutrițional adecvat pentru pacienții cu ADPKD.
Tabel: Linii Directoare Nutriționale și Lifestyle în ADPKD
V. Terapia de Substituție Renală (TRS) și Progrese în Transplant
V.A. Opțiuni Standard de TRS
Când ADPKD progresează către insuficiență renală (stadiul final), rinichii nu mai pot menține homeostazia internă. În acest moment, devine necesară Terapia de Substituție Renală (TRS). Opțiunile standard includ dializa (hemodializa sau dializa peritoneală) și transplantul renal clasic (alotransplantul).
Transplantul renal rămâne cea mai eficientă soluție de TRS, oferind o îmbunătățire semnificativă a supraviețuirii și a calității vieții comparativ cu dializa.
V.B. Managementul Alotransplantului și Imunosupresia Cronică
Succesul pe termen lung al unui alotransplant depinde de un plan de imunosupresie individualizată. Acest plan este conceput pentru a crește tolerabilitatea, siguranța și aderența pacientului pe termen lung, minimizând riscul de respingere a grefei.
Monitorizarea post-transplant este complexă și include screeningul și managementul complicațiilor asociate cu terapia imunosupresoare, cum ar fi complicațiile metabolice (diabet, dislipidemie) și riscul malign crescut. Deoarece mulți pacienți cu ADPKD necesită transplant la o vârstă relativ tânără (începând cu 55 de ani pentru PKD1 ), nevoia de imunosupresie cronică pe parcursul a decenii reprezintă o povară clinică semnificativă.
V.C. Orizontul Toleranței la Transplant: Strategii Protolerogenice
Obiectivul major al cercetării în transplantologie este atingerea toleranței imune, care ar permite funcționarea grefei pe termen lung fără a fi nevoie de imunosupresie cronică.
Inducerea Chimerismului Hematopoietic: Strategiile protolerogenice bazate pe inducerea chimerismului hematopoietic (prezența celulelor imune ale donatorului în măduva osoasă a primitorului) s-au dovedit a fi singurele eficiente în unele protocoale de transplant renal, oferind posibilitatea de a opri terapia imunosupresoare.
Co-transplantul Organ-Măduvă Osoasă Vascularizată (VBMT): O abordare de avangardă este co-transplantul de organ cu Măduvă Osoasă Vascularizată (VBMT). VBMT este o grefă hibridă, funcționând ca un organ solid dar conținând celule stromale cu potențial imunomodulator. Integrarea acesteia în transplantul de organ solid reprezintă un pas important pentru inducerea toleranței.
Avantajele potențiale ale VBMT includ: debutul imediat al reconstituției hematopoietice, furnizarea de celule stromale proprii pentru reînnoirea celulară și asigurarea unui mediu imunomodulator, toate contribuind la inducerea toleranței. Pentru pacienții cu boli cronice cum este ADPKD, care se confruntă cu perspectiva imunosupresiei pe termen lung, atingerea toleranței prin chimerism sau VBMT reprezintă un salt uriaș de la o strategie de supraviețuire a grefei la un potențial funcțional de vindecare.
VI. Orizontul Inovațiilor: Medicina Regenerativă și Genetică
Cercetările de avangardă se concentrează pe depășirea limitărilor TRS curente, prin dezvoltarea unor metode care fie elimină necesitatea de donatori umani, fie vizează repararea defectului genetic la sursă.
VI.A. Xenotransplantul Renal: Soluția la Deficitul de Donatori
Deficitul cronic de donatori de organe este o problemă majoră pentru pacienții cu IR în stadiu final, inclusiv pentru cei cu ADPKD. Xenotransplantul (transplantul de organe de la o altă specie, în prezent porcul, la om) oferă o soluție potențial nelimitată la această criză.
Progresele recente au fost facilitate de tehnici de editare genetică (de exemplu, CRISPR-Cas9) care modifică genomul porcului pentru a elimina genele responsabile de respingerea hiperacută și pentru a adăuga gene umane care modulează imunitatea. Stadiul cercetării a progresat rapid, iar studiile clinice și preclinice recente sugerează că este “Timpul să se treacă la Trialuri Clinice” pentru xenotransplantul renal. Dacă va fi implementat cu succes, xenotransplantul ar putea scurta drastic listele de așteptare, oferind o nouă speranță pacienților cu insuficiență renală.
VI.B. Ingineria Tisulară și Rinichii din Celule Stem (Organogenesis)
O viziune mai îndepărtată, dar cu potențial curativ, este ingineria tisulară. Cercetările utilizează celule stem pluripotente pentru a genera in vitro structuri renale primitive numite organoizi. Acești organoizi sunt deja instrumente valoroase pentru modelarea bolii ADPKD și pentru screeningul de noi medicamente.
Obiectivul final al bioingineriei de organe este crearea unui rinichi complet funcțional, de dimensiuni transplantabile, utilizând celulele stem proprii ale pacientului și scheleți aceluari. O astfel de realizare ar elimina complet necesitatea imunosupresiei cronice, o problemă inerentă atât în alotransplant, cât și în xenotransplant.
VI.C. Repararea Rinichilor Afectați de ADPKD (Terapia Genică)
ADPKD este o boală monogenică, dar timp de decenii nu au existat strategii terapeutice care să abordeze cauza fundamentală (mutațiile PKD1 sau PKD2).
Strategia MicroARN (miR-17 Targeting): Cea mai recentă direcție de cercetare se concentrează pe o nouă strategie de terapie genică care vizează o cale de reglare moleculară specifică. S-a descoperit că gena PKD1 conține un situs de legătură pentru microARN-ul miR-17, care este supraexprimat în modelele de ADPKD și duce la scăderea stabilității ARNm PKD1 și, implicit, la reducerea nivelurilor de Polycystin-1.
Cercetările au arătat că blocarea legării miR-17 la PKD1 (fie prin suprimarea situsului de legătură, fie prin utilizarea unui medicament anti-miR-17) a crescut stabilitatea lanțului de ARNm, a mărit nivelurile de Polycystin-1 și a reușit să încetinească creșterea chisturilor renale.
Această interacțiune moleculară reprezintă o țintă terapeutică extrem de promițătoare. Spre deosebire de Tolvaptan, care acționează asupra unui efector (cAMP) și doar încetinește progresia, terapia genică (anti-miR-17) are potențialul de a adresa defectul molecular la sursă, prin restabilirea nivelului critic de Polycystin funcțională. Dacă această funcție poate fi restabilită și menținută, boala ar putea fi oprită sau chiar vindecată funcțional, o perspectivă net superioară soluțiilor de substituție.
VII. Întrebări Frecvente (FAQ) și Concluzii Clinice
VII.A. Întrebări Frecvente (FAQ)
- Cum știu dacă ADPKD-ul meu este “cu progresie rapidă” și dacă sunt eligibil pentru Tolvaptan? Progresia rapidă este determinată în principal prin stratificarea genotipică (mutațiile PKD1 sunt asociate cu progresie mai rapidă, în medie cu 20 de ani mai rapidă decât PKD2) și prin măsurătorile imagistice seriale ale Volumului Renal Total (TKV). Pacienții cu creștere rapidă a TKV și VFR relativ păstrată sunt eligibili pentru tratamentul cu Tolvaptan.
- Este Hipertensiunea Arterială cauzată de sare în ADPKD? Nu în primul rând. HTA este cauzată în mare parte de activarea excesivă a sistemului Renină-Angiotensină-Aldosteron (RAAS) ca urmare a ischemiei renale induse de chisturi. Cu toate acestea, excesul de sare trebuie evitat pentru a optimiza controlul tensiunii arteriale, care este vital pentru protecția renală și cardiovasculară.
- Pot copiii să ia Tolvaptan sau să fie testați genetic? Tolvaptan este aprobat doar pentru pacienții adulți (18 ani și peste). Screeningul de rutină al copiilor sub 18 ani nu este recomandat în absența unei terapii aprobate, din cauza implicațiilor psihologice și a riscurilor legate de asigurări.
- Care este riscul de anevrisme cerebrale și este necesar screeningul? Anevrismele vasculare cerebrale sunt o complicație severă și reprezintă un factor de prognostic negativ important. Screeningul (de obicei prin angiografie RMN) este adesea recomandat pacienților, în special celor cu istoric familial de anevrisme sau hemoragii subarahnoidiene.
- Ce opțiuni există dacă am nevoie de transplant, dar nu găsesc un donator? În prezent, soluția standard este așteptarea unui donator (decedat sau viu). În viitorul apropiat, progresele în xenotransplantul renal (utilizarea rinichilor de porc modificați genetic) ar putea oferi o sursă alternativă rapidă și abundentă de organe.
VII.B. Sinteză Clinică și Direcții Viitoare de Cercetare
Managementul contemporan al Bolii Polichistice Renale Autosomal Dominante s-a transformat dintr-o simplă îngrijire de suport într-o abordare multi-țintă. Paradigma actuală se bazează pe trei piloni principali: (1) Terapia Țintită Molecular (Tolvaptan) pentru a suprima axa cAMP; (2) Controlul Intensiv al Riscului Cardiovascular (IECA/SARTANs) pentru a bloca RAAS și a proteja organele țintă; și (3) Intervenții Nutriționale Mecanice (hidratarea anti-vasopresină).
Viitorul terapeutic al ADPKD este definit de o convergență de inovații care promit soluții radicale:
- Toleranța Imună: Dezvoltarea co-transplantului de organ cu măduvă osoasă vascularizată (VBMT) și a strategiilor de chimerism hematopoietic urmărește transformarea transplantului dintr-o terapie de substituție dependentă de imunosupresie într-o vindecare funcțională.
- Substituția Organelor: Xenotransplantul renal reprezintă o soluție pragmatică, iminentă, la problema deficitului global de donatori, având potențialul de a salva milioane de vieți prin utilizarea organelor de porc genetic modificate.
- Terapia Genică Curativă: Strategii precum țintirea microARN-ului miR-17 oferă o viziune de reparare internă a rinichiului, prin restabilirea nivelurilor de Polycystin-1, atacând astfel defectul genetic fundamental al bolii și oferind speranța de a opri sau chiar vindeca ADPKD.
Prioritizarea cercetării în terapiile genice și celulare (repararea internă) este esențială, deoarece acestea oferă o soluție superioară pe termen lung, depășind limitările inerente ale terapiilor de substituție (dializa și transplantul).